Untersuchung der Glykosylierung in hämatologischen Systemerkrankungen
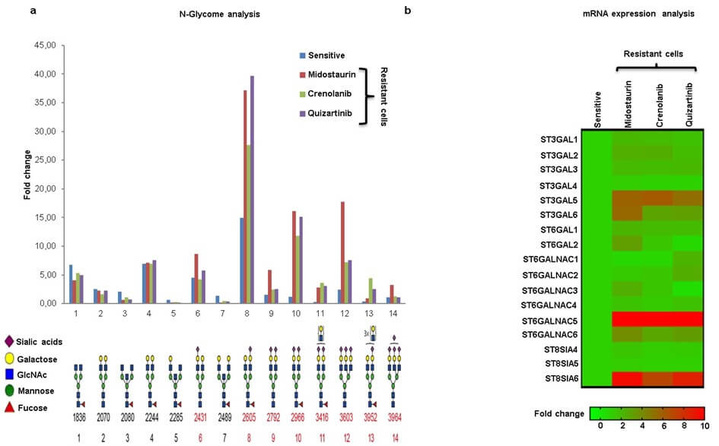
Abbildung 1:
Bei FLT3 Inhibitor resistenten akuten myeloischen Leukämiezellen (rot, gelb und lila) wird eine im Vergleich zur sensitiven Leukämiezelle (blau) vermehrte Glykosylierung der Tumorzelloberfläche beobachtet (A), dies verursacht durch eine Hochregulierung von Enzymen, sogenannten Sialyltransferasen (B).

Abbildung 2:
Eine Reduktion der Zuckermoleküle / Glykosylierung auf der Tumorzelloberfläche führt zur Effektivitätssteigerung der NK-Zell vermittelten anti-Tumor Aktivität. NK Zellen sind in rot markiert and apoptotische Zellen sind in grün markiert. In A) ist die Tumorzelloberfläche unverändert, in B) nach Neuraminidase Behandlung sind die Zellen ohne die schützende Glykokalyx ‚Tarnkappe‘. In Co-Kultur mit NK Zellen zeigt sich in B) eine im Vgl zu A) deutlich gesteigerte Immunreaktion.
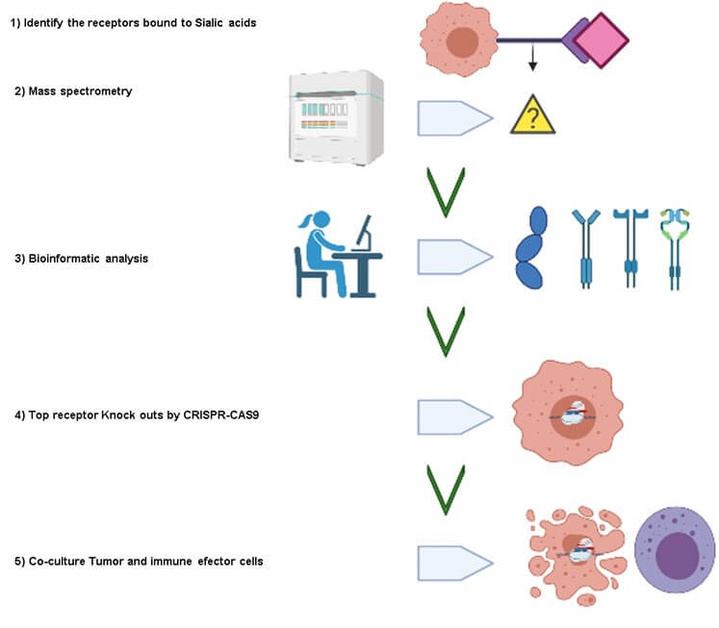
Abbildung 3:
Vorgeschlagenes Arbeitsprogramm um bislang unbekannte Bindungspartner der Glycokalyx zu identifizieren.
Team
Die AG Kortüm ist dem Lehrstuhl für translationale Myelomforschung und der Medizinischen Klinik 2, Lehrstuhl für Hämatologie und Onkologie (Prof. H. Einsele) zugeordnet. Der Fokus der Arbeitsgruppe umfasst grundlagenwissenschaftliche wie auch translationale Fragestellungen. Untersucht wird im Wesentlichen die klonale Evolution von hämatologischen Tumorerkrankungen, mit einem Schwerpunkt auf dem Multiplen Myelom und der Akuten myeloischen Leukämie. Untersucht werden genetische, epigenetische und immunologische Veränderungen, sowie die Selektionsprozesse unter verabreichter Tumortherapie. Die Arbeitsgruppe konnte in den letzten Jahren wegweisende Mechanismen der Resistenzentwicklung gegenüber immunmodulatorischen Substanzen, Proteasominhibitoren sowie gegenüber BCMA gerichteter Immuntherapie beim Multiplen Myelom veröffentlichen. Ganz aktuell wurde im April 2021 durch den Antragsteller eine Arbeit als Erstautor in Communications Biology über den Einfluss von Actindysregulation auf die Sensitivität von Midostaurin in der FLT3 mutierten akuten myeloischen Leukämie publiziert.
Die AG Kortüm hat in Kollaboration mit der AG Rasche eine diagnostische Pipeline für Routinepatienten mit AML und MM etabliert, die Ganzgenomsequenzierung und Prognostizierung mittels Genexpressionsprofilen einschließt. Über Kooperation mit Prof. Markus Sauer werden den Patienten hochauflösende dSTORM Mikroskopien, über Kooperation mit Prof. Dr. Dr. Andreas Beilhack minimale Resterkrankungsdiagnostik angeboten.
Die AG Kortüm ist eingebunden in die KFO5001 ‚Resolve Pain‘, sowie in die Antragstellung des positiv begutachteten SFB ‚CRC/TRR336 - Deciphering and exploiting ubiquitin networks in cancer‘. Klinische Forschung erfolgt in kommerziellen Phase 1-3 Studien sowie in akademisch initiierten IITs, bspw über die Deutsche Studiengruppe Multiples Myelom.
Motivation und Innovation
Die Situation von Patienten mit hämatologischen Krebserkrankungen zu verbessern ist Ziel all unserer Bemühungen. Dies kann im Wesentlichen nur durch ein besseres Verständnis der zu Grunde liegenden Pathomechanismen gelingen. Diese aufzudecken ist Ziel unserer Arbeitsgruppe.
Welche Ziele verfolgt das Projekt?
Wir wollen verstehen wie die Veränderung der Zuckerstruktur auf Tumorzellen das Ansprechen auf Anti-Tumortherapie beeinflusst und wollen Ansätze identifizieren, die wir für therapeutische Interventionen nutzen können.
Ansatz des Forschungsprojektes
Wir schlagen folgendes Arbeitsprogramm vor:
- Beschreibung von Veränderungen der Tumorzell-Glykokalyx bei TKI (Tyrosin-Kinase-Inhibitoren) resistenter AML mittels Glycan MicroArray.
- Differentielle Analyse von Siglec Liganden/Galectin assoziierten Proteinen zwischen TKI sensitiver und TKI resistenter AML mittels Durchflusszytometrie.
- Identifizierung neuer Siglec Liganden bzw Galectin bindender Rezeptoren mittels Massenspektrometrie.
- CRISPR /Cas9 Knockout Experimente, in denen die in 3) identifizierten Rezeptoren ausgeschaltet werden.
Welche Krebserkrankung soll behandelt werden?
Primär sollen die Versuche in AML durchgeführt werden, Validierungen im MM werden zum späteren Zeitpunkt angestrebt.
Warum soll das Forschungsprojekt unterstützt werden?
Tumorzellen interagieren mit ihrer Umwelt unter anderem über ihre Oberflächenstruktur. Mittels veränderter Zuckermoleküle gelingt es ihnen sich wie mit einer Art ‘Tarnkappe’ vor den Angriffen des Immunsystems zu schützen. Wir hoffen mit unserer Forschung einen Beitrag dazu zu leisten dieses Kommunikationssystem besser zu verstehen und so beeinflussen zu können, dass Immunthrerapien besser wirken können und Resistenzmechanismen durchbrochen werden. Dr. Andoni Garitano ist ein international ausgewiesener Experte in der Geneditierung und der Zellkultur. Die Universitätsklinik Würzburg stellt ein Spitzenzentrum in der immunologischen Behandlung von Tumorerkrankungen dar. Die Förderung wird dazu genutzt werden die Umsetzung dieses ambitionierten Projektes zu beschleunigen, mit dem Ziel die gewonnenen Erkenntnisse möglichst zeitnah in der Klinik zur Anwendung zu bringen.
