Entschlüsselung der multizellulären Knochenmarksarchitektur vor und nach CAR-T-Zelltherapie
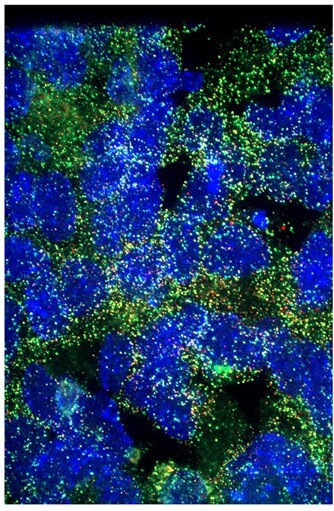
Abbildung 1:
seqFISH-signal des Gens EEF2 im Knochenmark (AG Grün).

Abbildung 2:
Dr. Leo Rasche

Abbildung 3:
Prof. Dr. Dominic Grün
Team
Prof. Dr. rer. nat. Dominic Grün ist Inhaber des Lehrstuhls für „Computational Biology of Spatial Biomedical Systems“ an der Universität Würzburg. Aus seiner Arbeitsgruppe wird Dr. Gabrijela Dumbovic das Projekt unterstützen mit weitreichender Expertise in single-cell mRNA-seq und hochauflösender Mikroskopie, sowie der bioinformatischen Datenanalyse. Daneben wird Dr. Ankit Agrawal als weiterer Postdokotorand das Projekt mit Expertise in bioinformatischer Datenanalyse unterstützen. Der Lehrstuhl von Prof. Grün ist direkt an das CAIDAS Zentrum für künstliche Intelligenz eingebunden.
Dr. med. Leo Rasche ist Oberarzt an der Medizinischen Klinik 2 der Universitätsklinik Würzburg im Bereich der Hämatologie und Onkologie. Er wird unterstützt durch Mara John (PhD Candidate, vormals Marburg), sowie durch Emilia Stanojkovska (MTA). Es besteht eine enge Kollaboration mit Emmanuel Saliba, PhD (Single Cell Center Würzburg) und Claudia Haferlach (MLL, München).
Motivation und Innovation
Das Knochenmark ist ein multizelluläres Ökosystem, in dem neben Zellen der Blutbildung auch Immunzellen, Knochen- und Knorpelzellen sowie Blutgefäße anzutreffen sind. Interessanterweise liegen diese unterschiedlichen Zellen nicht ungeordnet nebeneinander, sondern bilden mikroanatomische Strukturen aus in denen sie in spezifischer Nachbarschaft zueinander wachsen. Man spricht auch von Nischen. Diese Nischen spielen für das Voranschreiten von Tumorerkrankungen eine wesentliche Rolle. Es konnte beispielsweise gezeigt werden, dass die Immunabwehr von Tumoren von bestimmten Zellen in der Knochenmarknische gehemmt wird. Einige Tumorerkrankungen, so wie das Multiple Myelom, können sogar nur in der Nische überleben, da die Tumorzellen von Nachbarzellen mit kritischen Wachstumsfaktoren versorgt werden. In unserem Projekt haben wir nun erstmals die Möglichkeit, das komplexe System des Knochenmarks mithilfe der sog. seqFISH Technologie zu entschlüsseln. Mit dieser Technologie lässt sich eine große Anzahl an Genen gleichzeitig im Knochenmark mikroskopisch messen, so dass – in Kombination mit der Einzelzell-mRNA-Sequenzierung – die Lokalisation aller Zelltypen im Knochenmark bestimmt werden kann. Dies erlaubt eine hochauflösende Analyse der Zelltypkomposition und ermöglicht die Vorhersage molekularer Wechselwirkungen zwischen Tumorzellen und Zellen der Knochenmarksnische, die für die Tumorentwicklung essentiell sein können.
Welche Ziele verfolgt das Projekt?
In diesem Projekt widmen wir uns der immunsuppressiven Knochenmarknische. Die seqFISH Methode erlaubt uns, neben der durch Einzelzell-mRNA-Sequenzierung bestimmten zellulären Komposition auch die räumliche Anordnung der Zellen in der Analyse mit zu berücksichtigen. Wir möchten unbekannte Nischen im Knochenmark entdecken und charakterisieren, die an der Resistenzbildung gegenüber neuen Immuntherapien beteiligt sind. Zudem möchten wir erstmalig beschreiben, wie sich das Knochenmark nach einer erfolgreichen Immuntherapie normalisiert und so vor einem Rückfall der Krebserkrankung schützt. Wir wollen zudem die Eigenschaften der Tumorzellen entschlüsseln, die einer Tumorzelle erlauben, trotz Immuntherapie zu überleben. Letztlich sollen unsere Erkenntnisse dazu führen, zukünftige Immuntherapien deutlich zu verbessern.
Ansatz des Forschungsprojektes
Als Schlüsseltechnologie kommt in unserem Labor die Einzelzell-mRNA-Sequenzierung und die Mikroskopie-basierte seqFISH Methode zum Einsatz. Darüber hinaus besitzt unser Labor die erforderliche Expertise des maschinellen Lernens und der künstlichen Intelligenz, um die gewonnen, hoch-komplexen multidimensionalen Daten zu analysieren.
Welche Krebserkrankung soll behandelt werden?
Blutkrebserkrankungen wie Leukämie und Multiples Myelom.
Warum soll das Forschungsprojekt unterstützt werden?
Unser Ziel ist es, in Zukunft auch den Krebspatienten helfen zu können, die von den aktuellen Erfolgen der Immuntherapie noch nicht profitieren können. Wenn es uns gelingt die Resistenzmechanismen von Tumorzellen zu entschlüsseln, können wir neue Behandlungsstrategien entwickeln, um bei noch mehr Patienten den Tumor auch langfristig zu kontrollieren.
