Super-Resolution Mikroskopie zur Verbesserung der personalisierten Immuntherapie maligner Erkrankung

Das Team der AG Sauer
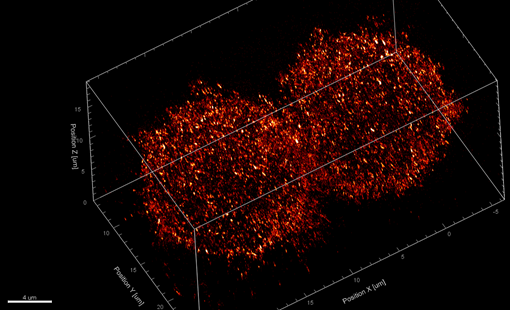
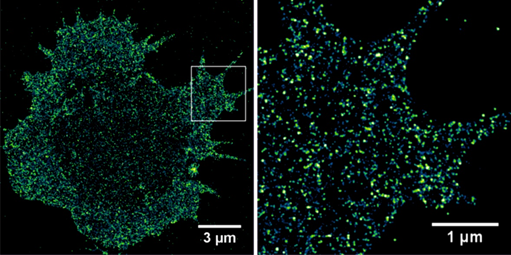
Die Abbildungen zeigen Super-Resolution Mikroskopie Bilder tumorassoziierter Antigene auf primären Tumorzellen die mit der Methode dSTORM aufgenommen wurden. Tumorzellen mit geringer Dichte tumorspezifischer Antigene können in der Routinediagnostik mittels Durchflusszytometrie nicht erkannt und quantitativ erfasst werden.
Team
In der AG Sauer arbeiten Doktoranden und Postdocs der Biologie, Physik, Chemie und Medizin interdisziplinär an der Lösung biomedizinischer Fragestellung mit hochempfindlichen Mikroskopiemethoden.
Motivation und Innovation der Arbeitsgruppe
Für die Personalisierte Immuntherapie, d.h. für die Identifikation der geeignetsten effizienten und nebenwirkungsfreien Therapie, ist die Ermittlung eines individuellen Antigenprofils auf primären Tumorzellen und Gewebebiopsien solider Tumore unabdingbar. Da Immuntherapien schwere Nebenwirkungen induzieren können und auch sehr kostspielig sind, ist die Ermittlung eines individuellen und quantitativen Antigenprofils auf den Tumorzellen, aber auch auf gesunden Zellen/Geweben unumgänglich, um unnötige Behandlungen und Nebenwirkungen zu verhindern. Die derzeit in den Kliniken etablierten immunhistochemischen Färbereaktionen für Gewebeschnitte solider Tumore und durchflusszytometrischen Verfahren (FACS) für im Blut zirkulierende Tumorzellen sind jedoch in ihrer Empfindlichkeit begrenzt und nicht für eine quantitative Erfassung weniger Antigenmoleküle pro Zelle geeignet.
Welche Ziele verfolgt das Projekt?
Wir wollen tumorassoziierte bzw. tumorspezifische Antigene auf primären Tumorzellen und Gewebebiopsien solider Tumore quantitativ mit nahezu molekularer Auflösung mittels der in Würzburg entwickelten Super-Resolution Mikroskopiemethode dSTORM erfassen, um damit eine effiziente „personalisierte“ Krebsimmuntherapie einleiten zu können. Durch die quantitative Bestimmung der Dichte, Verteilung und Modulation der Antigenexpression auf malignen und gesunden Zellen sollen zielgerichtete Immuntherapeutika, ohne Nebenwirkungen und damit personalisiert eingesetzt werden.
Wir knüpfen an unsere Arbeit die Hoffnung, in Zukunft eine besonders präzise, besonders effektive und nebenwirkungsarme Behandlung anbieten zu können zum Nutzen der Patienten.
Was ist der Ansatz des Forschungsprojektes?
Neue immuntherapeutische Methoden basieren auf der direkten oder indirekten Aktivierung von T-Zellen gegen tumorassoziierte Antigene auf Tumorzellen und soliden Tumoren mittels Antikörpern oder Antikörpervarianten (IgG Antikörper, CAR-Ts, BiTEs, Hemibodies). Ein hochsensitives und quantitatives Screening nach tumorassoziierten Oberflächenmarkern wie es für den optimalen Einsatz dieser neuen Therapeutika wichtig ist, ist mit Hilfe der derzeit routinemäßig eingesetzten Verfahren (Immunhistochemie (IHC), Durchflusszytometrie (FACS)) bei niedrig exprimierten tumorassoziierten Antigenen aber nicht möglich. Bei geringer Antigenkonzentration fällt der Test entweder negativ aus oder lässt sich nicht eindeutig beurteilen.Um eine sichere Entscheidung für oder gegen eine Immuntherapie treffen zu können, muss der Expressionsgrad tumorassoziierter Antigene auf Zellen und in Gewebeschnitten quantitativ mit Hilfe der einzelmolekülempfindlichen, hochauflösenden Fluoreszenzmikroskopie (dSTORM) erfasst werden. Hierzu müssen verschiedene Antigene auch in geringer Konzentration, wie bspw. CD19, CD20, CD38, CD138 oder tumorspezifische HLA/Peptid-Komplexe spezifisch mit hoher Nachweissicherheit mittels farbstoffmarkierten Antikörpern quantitativ erfasst werden.
Welche Krebserkrankung soll behandelt werden?
Wir fokussieren derzeit unsere Arbeiten auf die Quantifizierung von CD19, CD20, CD38 und BCMA auf Tumorzellen (Leukämie-, Lymphom- bzw. Myelomzellen aus dem peripheren Blut bzw. Knochenmark) und zum Vergleich auf normalen Blutzellen (aus dem peripheren Blut) mit Hilfe der dSTORM Methodik. Gleichzeitig wird die Expression von ko-stimulatorischen und inhibitorischen Molekülen (z.B. Checkpoint Liganden) untersucht und quantifiziert.
Warum soll das Forschungsprojekt unterstützt werden?
Aus medizinischer, gesundheitsökonomischer und gesellschaftlicher Sicht führt kein Weg am Einsatz einzelmolekülempfindlicher Super-Resolution-Mikroskopie-Methoden wie dSTORM anstelle der in Kliniken derzeit verwendeten enzymatischen Färbereaktionen (Gewebeschnitte) oder der FACS-Analyse (Zellen) zur quantitativen Erfassung der Tumorantigene vorbei, da nur so eine effiziente personalisierte Behandlung möglich ist und dadurch diejenigen Patienten vor Therapiebeginn identifiziert werden, die tatsächlich von den neuen Therapeutika profitieren. Die Sensitivität, Reproduzierbarkeit und Quantifizierbarkeit gängiger immunhistochemischer Verfahren kann eine solche Stratifizierung jedoch nicht bzw. nur unzureichend leisten. Insbesondere ist die Sensitivität der Standardanalysen nicht ausreichend, um die Expression bzw. Nichtexpression von geringen Antigenmengen auf Tumoren nachzuweisen, die für einen erfolgreichen Einsatz der neuen Therapeutika notwendig sind. Es kann daher dazu kommen, dass Antigen-negative Patienten unnötigerweise oder falsch behandelt werden, da es nicht gelingt den Expressionsstatus des therapeutisch adressierten Antigens klar zu verifizieren.
Wir arbeiten mit großem Engagement an der Entwicklung und klinischen Umsetzung einer völlig neuen Art der Immuntherapie. Wir knüpfen an unsere Arbeit die Hoffnung, in Zukunft eine besonders präzise, besonders effektive und nebenwirkungsarme Behandlung anbieten zu können zum Nutzen der Patienten.
