Wiederherstellen der Immunabwehr im MYC-getriebenen Bauchspeicheldrüsenkrebs
Dieses Projekt wurde 2023 von der Stiftung "Forschung hilft" mit 17.500 Euro gefördert.

Team
Bastian Krenz arbeitet seit 2018 in der Forschungsgruppe von Prof. Dr. phil. Martin Eilers, die die Rolle von MYC Proteinen in verschiedenen Krebserkrankungen untersucht.
Motivation und Innovation
Die Deregulierung von Proteinen der MYC Familie in Tumoren ist unabhängig von der Entität allgegenwärtig in Humantumoren und die wichtige Funktion von MYC, das Wachstum von Tumoren zu treiben, ist gut beschrieben. In den letzten Jahren rückte jedoch eine weitere Funktion der MYC Proteine zunehmend in den Fokus der Forschung. Tumore sind exzellent darin, sich vor dem Immunsystem zu verstecken, um zu verhindern, dass sie von Zellen des eigenen Immunsystems erfolgreich bekämpft werden. In zahlreichen Tumorentitäten wurde bereits gezeigt, dass MYC Proteine von zentraler Bedeutung in diesem Versteckspiel sind. Wir konnten erfolgreich nachweisen, dass das Ausschalten von MYC in einem Mausmodell für Bauchspeicheldrüsenkrebs zur Bekämpfung des Tumors durch das Immunsystem führt. Da MYC Proteine auch in gesunden Zellen eine wichtige Rolle spielen und aufgrund ihrer speziellen Struktur nur sehr schwer wirksamen Hemmstoffe gegen sie entwickelt werden können, ist das direkte Abschalten dieses Onkoproteins eine große Herausforderung. Umso wichtiger ist es, die Prozesse vollständig zu verstehen, die es den MYC Proteinen ermöglichen Tumorzellen vor dem Immunsystem zu verstecken. Diese Erkenntnis kann dann im nächsten Schritt genutzt werden, um alternative Zielproteine zu identifizieren und darauf basierend eine ähnlich spezifische aber deutlich nebenwirkungsärmere Therapieansätze zu entwickeln.

Abbildung 1: MYC Proteine stärken Tumorzellen, indem sie die Resilienz gegen verschiedene Arten von Stress erhöhen und gleichzeitig die Sichtbarkeit für das Immunsystem stark reduzieren. Die Manipulation von MYC oder seiner Funktionen erlaubt eine Infiltration mit Effektorzellen.
Welche Ziele verfolgt das Projekt?
Jüngste Forschungsergebnisse zu MYC Proteinen zeigen, dass eine Hauptfunktion dieser Onkoproteine die Steigerung der Stress Resilienz von Tumorzellen ist (Abbildung 1): Sie können schneller wachsen, passen ihre Stoffwechsel an das schnelle Wachstum an, fördern die Reparatur von Schäden im Erbgut und reduzieren vor allem auch ihre Sichtbarkeit für das Immunsystem. Ziel dieses Projektes ist es, durch das Entschlüsseln der mechanistischen Details dieser zentralen Funktion von MYC den Weg für die Entwicklung von Therapien zu ebnen, die in der Kombination mit CAR-T Zellen zur vollständigen Remission der Tumore führt.
Ansatz des Forschungsprojektes
Die Prognose für Patienten mit MYC getriebenen Tumoren ist oft deutlich schlechter als die für Patienten mit Tumoren, deren MYC Level niedriger sind. Grund dafür ist, dass MYC Proteine die Transkription – also das Abschreiben der DNA in RNA – deutlich beschleunigen. Das erlaubt zum einen das enorm schnelle Wachstum, führt aber auch zu dem Problem für Tumorzellen, dass dabei „Nebenprodukte“ entstehen, die an virale RNA und DNA erinnern und deswegen das Immunsystem aktivieren können (Abbildung 2). Um das zu verhindern, „versteckt“ MYC diese Nebenprodukte und sorgt dafür, dass das Immunsystem nicht alarmiert wird. Diese Eigenschaft ist zwar vorteilhaft für die Tumorzellen, stellt aber gleichzeitig auch eine Art „Achillesferse“ dar. Wir versuchen diese Achillesferse der Tumorzellen zu treffen, um das Versteckspiel zwischen Tumoren und Immunsystem zu beenden. Immuntherapien bei der sogenannte CAR-T Zellen zum Einsatz kommen, zeigen zwar bei malignen Erkrankungen des blutbildenden Systems durchschlagenden Erfolg, hat aber leider bisher bei soliden Tumoren wenig bis keinen Effekt. Unsere vorläufigen Daten zeigen, dass die Hemmung von MYC die Infiltration von Immunzellen in den Tumor zulässt. Dies hat zur Konsequenz, dass auch in solide Tumore vom Immunsystem erkannt und eliminiert werden können. Vorläufige Experimente in einen hochaggressiven Mausmodell für Bauchspeicheldrüsenkrebs zeigen, dass die Transplantation von hochpotenten CAR-T Zellen zwar keinerlei Effekt auf Tumore mit hohen Leveln an MYC Protein hat, das genetische Abschalten von MYC allerdings in Kombination mit CAR-T Zellen zur vollständigen Heilung der Mäuse führt.
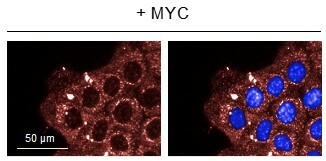
Abbildung 2: Hochimmunogene doppelsträngige RNA (rot) entsteht als Nebenprodukt in stark proliferierenden Zellen (Zellkern in blau). MYC unterdrückt die Erkennung dieser RNA, um die Aktivierung des Immunsystems zu verhindern.
Welche Krebserkrankung soll behandelt werden?
Die wichtige onkogene Funktion von MYC Proteinen als „Immunsuppressiva“ wurde bereits für unter anderem Bauchspeicheldrüsenkrebs, Lungenkrebs, Neuroblastom und Leukämie beschrieben. Im ersten Schritt soll der zur Immunsuppression führende Mechanismus in Bauchspeicheldrüsenkrebs noch detaillierter untersucht werden. Bauchspeicheldrüsenkrebs tritt mit steigender Häufigkeit in der westlichen Hemisphäre auf und Therapieansätze haben sich in den letzten 40 Jahren kaum verbessert und nur ein kleiner Bruchteil der Patienten überlebt mehr als 5 Jahre nach der Diagnose. Die Omnipräsenz von MYC in Humantumoren deutet aber darauf hin, dass dieser Mechanismus stark konserviert ist und die Ergebnisse aus den Untersuchungen im Bauchspeicheldrüsenkrebs auch Rückschlüsse zur Behandlung anderer Tumorarten erlauben werden.
Warum soll das Forschungsprojekt unterstützt werden?
Unsere Forschung zeigt, dass der Rückgang von Tumoren nach dem Hemmen von MYC vollständig von einem funktionalen Immunsystem abhängig ist. Wir wollen daher Ansätze für Tumortherapien entwickeln, die auf einer erhöhten Sichtbarkeit der Tumorzellen für das Immunsystem nach Hemmung der Funktion von MYC beruhen. Bisherige Therapieansätze zielen vor allem darauf ab, die Fähigkeit von MYC zu treffen, die das Wachstum der Tumorzellen fördert. Bei diesem Ansatz werden allerdings auch physiologisch wichtige Funktionen von MYC in gesunden Zellen getroffen, die z.B. bei der Entwicklung, bei der Wundheilung oder bei der Regeneration von Geweben unabdingbar sind. Das Hemmen der immunsuppressiven Funktion von MYC dagegen verspricht deutlich nebenwirkungsärmere Therapien, die auch auf weitere maligne Erkrankungen übertragen werden können.
