Epigenetische und Glykaneditierungen zur Steigerung der antitumoralen Reaktion von CAR-T-Zellen
Dieses Projekt wurde 2024 von der Stiftung "Forschung hilft" mit 13.000 Euro gefördert.

Abbildung 1: Ein engagiertes Team naturwissenschaftlicher und medizinischer Forscher unterstützt die Arbeiten an diesem spannenden CAR-T-Zellprojekt
Team
Der Antragsteller, Andoni Garitano, ist medizinischer Wissenschaftler am Lehrstuhl für Zelluläre Immuntherapie (Prof. Dr. med. Michael Hudecek) an der Medizinischen Klinik und Poliklinik II (Prof. Dr. med. Hermann Einsele). Seit Januar 2022 leitet er das translationale Forschungsprogramm zur CAR-T-Zell Therapie bei der Akuten Myeloischen Leukämie (AML) mit einem Team bestehend aus Medizinstudenten, naturwissenschaftlichen Studenten und technischen Assistenten.
Die Forschungsgruppe hat Zugang zu voll ausgestatteten S2-Laboren, welche eine innovative molekulare Arbeit und Zellkultur ermöglichen. Neben Sicherheitswerkbänken, PCR-Maschinen, Zentrifugen, Mikroskopen, Kühlschränken, Gefrierschränken und einem kürzlich installierten hypoxischen Inkubator stehen drei FACS-Instrumente (drei MACSquant und ein FACS CantoII) für die phänotypische Untersuchung von Zellen und Durchführung von Proliferationstests zur Verfügung. Ein MACSquant Tyto steht für die Zellsortierung zur Verfügung. Ebenso vorhanden sind ein xCelligence und IncuCyte-Reader für kurz- und langfristige funktionale Messungen.
Motivation und Innovation
Die Therapie mit chimären Antigenrezeptor-T-Zellen (CAR-T) hat bei refraktären B-Zell-Malignomen mit CD19- und BCMA-CAR-T-Zellen beispiellose Erfolge erzielt. Dennoch hat die wachsende Erfahrung mit diesen biologischen Wirkstoffen gezeigt, dass die Remissionen bei einer beträchtlichen Anzahl von Patienten aufgrund einer schlechten Persistenz der CAR-T-Zellen und/oder einer Resistenz der Krebszellen nur von kurzer Dauer sein können. Geringe oder fehlende Expression/Detektion von Zielantigenen, die Zugänglichkeit zu Krebszellen und die Immunsuppression durch die Tumormikroumgebung sind nachweislich wichtige Ursachen für eine CAR-Resistenz.
Epigenetische Mechanismen wie die DNA-Methylierung und die Histon-Deacetylierung, die bei Krebs aus dem Gleichgewicht geraten, sind entscheidend für die Unterdrückung der Expression verschiedener Gene. Darüber hinaus ist die Glykosylierung, ein Prozess bei dem Zuckermoleküle nach der Translation an Proteine gebunden werden, ein charakteristisches Merkmal von Krebszellen. Sie spielt eine wichtige Rolle bei der Maskierung von Oberflächenmarkern, wodurch die Bindung von Antikörpern gestört wird. Darüber hinaus fungieren diese als Liganden für immunhemmende Rezeptoren auf Immun-Effektorzellen und tragen somit zur Immunsuppression bei.
Unser Hauptziel ist es, die Krebsreaktion von CAR-T-Zellen durch folgende Maßnahmen zu verstärken:
- Einsatz von epigenetischen Modulatoren zur Verbesserung der Expression von CAR-Zielantigenen und
- Einsatz modernster Technologie zur Entwicklung von CAR-T-Zellen, die Enzyme zur Beseitigung anormaler Glykosylierung exprimieren können.
Dieser Ansatz zielt darauf ab, die Antigenerkennung zu verbessern und gleichzeitig immunsuppressive Liganden zu reduzieren.
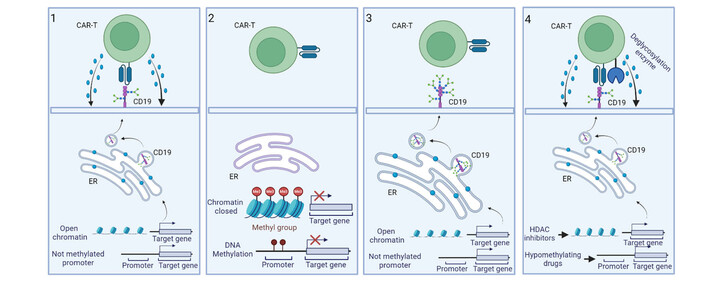
Abbildung 2: Drei verschiedene Szenarien und unser Ansatz zur Verbesserung der Antitumorwirkung der CAR-T-Therapie: 1) Ein aktiv transkribiertes Gen produziert ein Protein (CD19, Klassischer CAR-Zielmarker), das im endoplasmatischen Retikulum glykosyliert wird - ein Prozess, der für seine Expression auf der Zelloberfläche notwendig ist. In diesem Fall heften sich die CAR-T-Zellen an das richtig glykosylierte Antigen und zerstören die Krebszellen. 2) Wenn ein Gen aufgrund von DNA-Methylierung oder Histonmodifikationen, die Chromatinstruktur straffen, an der Transkription gehindert wird, kann es kein Protein produzieren. Infolgedessen können die CAR-T-Zellen nicht an das Antigen binden, sodass die Krebszelle überleben kann. 3) Ein aktiv transkribiertes Gen erzeugt ein Protein wie CD19. In einigen Krebszellen wird dieses Protein jedoch im endoplasmatischen Retikulum übermäßig glykosyliert, wodurch das Epitop maskiert wird. Folglich können CAR-T-Zellen nicht an das übermäßig glykosylierte Antigen binden, weshalb die Krebszelle überleben kann. 4) Unsere Strategie zur Überwindung der CAR-Resistenz umfasst zwei wichtige Schritte: Erstens werden wir die Expression des CAR-Zielgens steigern, das durch epigenetische Mechanismen unterdrückt wird. Dazu setzen wir hypomethylierende Wirkstoffe und Histon-Deacetylase (HDAC)-Inhibitoren ein. Zweitens werden wir die CAR-T-Zellen so verändern, dass sie ein Enzym produzieren, das übermäßige Zuckerketten entfernen kann, um das Antigen freizulegen. Dadurch kann die CAR-T-Zelle ihr Zielmolekül erkennen und die Krebszelle wirksam eliminieren.
Welche Ziele verfolgt das Projekt?
Das Hauptziel dieses Projekts besteht darin, die Antitumorantwort von CAR-T-Zellen zu verstärken, indem die Antigendichte auf den Tumorzellen erhöht und die Immunsuppression in der Tumormikroumgebung verringert wird.
Ansatz des Forschungsprojektes
Wir schlagen das folgende Arbeitsprogramm vor:
- Screening von epigenetischen Modulatoren, die eine robuste Expression von CAR-Zielantigenen sowohl bei hämatologischen als auch bei soliden Krebsarten induzieren.
- Screening von Glykoenzymen, die abweichende Glykane entfernen und die CAR-Zielerkennung verbessern sowie immunsuppressive Glykane reduzieren.
- Entwicklung von CAR-T-Zellen mit Glykosylierungs-Editierungsenzymen, die im vorherigen Schritt ausgewählt wurden.
- Bewertung der Steigerung der Antitumor-Wirksamkeit von CAR-T-Zellen, die Glykosylierungs-Editierungsenzyme exprimieren, in Kombination mit epigenetischen Modulatoren in präklinischen Modellen von hämatologischen und soliden Krebsarten.
Welche Krebserkrankung soll behandelt werden?
Akute Myeloische Leukämie (AML), sowie weitere hämatologische (z.B. Multiples Myelom) und onkologische Erkrankungen (z.B. Nierenzellkarzinom).
Warum soll das Forschungsprojekt unterstützt werden?
Unser Projekt würde von der Unterstützung durch „Forschung hilft“ in hohem Maße profitieren:
Bewältigung kritischer Herausforderungen: Der Erfolg der CAR-T-Zelltherapie wird durch verschiedene Hindernisse gebremst, wie z. B. einer geringen Antigendichte auf Krebszellen und einer immunsuppressiven Tumormikroumgebung. Indem wir diese Herausforderungen mit innovativen Ansätzen der epigenetischen Modulation und der Glykosylierungseditierung angehen, können wir die Effizienz der CAR-T-Zelltherapie steigern.
Innovation und Potenzial: Die Kombination aus epigenetischer Modulation und Glykosylierungs-Editierungsenzymen stellt einen neuartigen und vielversprechenden Ansatz im Bereich der Immuntherapie dar. Die finanzielle Unterstützung dieses Projekts wird uns in die Lage versetzen, diese innovative Strategie weiter zu erforschen und möglicherweise neue Wege zur Verbesserung der CAR-T-Zelltherapie und zur Revolutionierung der Krebsbehandlung zu erschließen.
Prä-klinischer Proof-of-Concept: Finanzielle Unterstützung ist entscheidend für die Validierung des Konzeptes. Der Nachweis der Durchführbarkeit und Wirksamkeit unserer Strategie wird entscheidend sein, um weitere Investitionen anzuziehen und die klinische Umsetzung voranzutreiben.
Translation in die klinische Anwendung: Unser Projekt ist in hohem Maße translational und zielt darauf ab, die klinischen Ergebnisse bei Krebspatienten direkt zu beeinflussen. Durch die Verbesserung der Wirksamkeit von CAR-T-Zellen und die Überwindung der Immunsuppression sowohl bei hämatologischen als auch bei soliden Krebserkrankungen haben wir die Möglichkeit, die Therapieergebnisse und die Lebensqualität der Patienten deutlich zu verbessern.
